May 25, 2019 Seitenansicht:427
Bisher gibt es keinen völlig idealen Elektrolyten für Lithiumbatterien. Die heute am häufigsten verwendeten organischen Elektrolyte sind eine hohe Ionenleitfähigkeit und ein breiter Temperaturbereich. Die Entwicklung neuer Elektrolyte ist unabdingbar, da es leicht ist, Feuer zu fangen und Sicherheitsunfälle zu verursachen. Die Entwicklung neuer Elektrolyte erfordert eine zuverlässige Theorie, aber da der Elektrolyt stärker beeinflussende Faktoren (wie Viskosität, Salzkonzentration, Auflösung, Ionenassoziation und Ionen-Lösungsmittel-Wechselwirkung) beinhaltet, ist der Migrationsmechanismus von Ionen nicht sehr klar. Wie wandern Lithiumionen in organischen Elektrolyten, Festelektrolyten und ionischen Flüssigelektrolyten?
Erstens der organische Elektrolyt
Der Elektrolyt wirkt als Träger innerhalb der Lithiumbatterie, die einen Transportweg für den Ionentransport zwischen dem positiven und dem negativen Material bereitstellt. Am Beispiel des Ladevorgangs wird Li + aus dem positiven aktiven Material entfernt und die Li + -Konzentration auf der Oberfläche der Festphasenteilchen der positiven Elektrode verringert, so dass ein Konzentrationsunterschied zwischen der Innenseite und der Oberfläche von auftritt das Teilchen, so dass das Li + Teilchen erzeugt, die von innen nach außen diffundieren. Gleichzeitig tritt Li +, das durch elektrochemische Reaktion auf der Oberfläche der Partikel erzeugt wird, in den Elektrolyten ein, und die lokale Konzentration des Grenzflächenbereichs in der Lösungsphase wird erhöht, was einen Konzentrationsunterschied innerhalb der Lösungsphase verursacht, was zu Diffusion und Migration führt von Li + von innen nach außen. Im negativen Elektrodenbereich wird, da die negativen Elektrodenpartikel elektrochemisch mit Li + im Elektrolyten reagieren, Li + in der Lösungsphase verbraucht und die Li + -Konzentration in der Lösungsphase verringert, was zu einem Konzentrationsunterschied führt, was zu Diffusion und Migration führt von Li + von außen nach innen in der Lösungsphase.
Gleichzeitig findet auf der Oberfläche der negativen Elektrodenpartikel eine elektrochemische Reaktion statt, und Li + wird interkaliert, um einen Konzentrationsunterschied innerhalb der Partikel zu verursachen, wodurch Li + von außen nach innen diffundiert. Am Separator verursacht Li + in diesem Bereich aufgrund des Konzentrationsunterschieds, der durch die positiven und negativen Elektroden verursacht wird, eine Diffusion und Migration von der positiven Elektrode zur negativen Elektrode, und der Entladungsprozess ist dem obigen Prozess entgegengesetzt. Aus dem obigen Verfahren ist ersichtlich, dass der normale und effiziente Betrieb der Lithiumbatterie hauptsächlich durch die Migration von Lithiumionen innerhalb der Batterie bestimmt wird. Die Migration von Lithiumionen wird durch die Eigenschaften des Elektrolyten eingeschränkt, und die Eigenschaften des Elektrolyten werden hauptsächlich durch die folgenden Faktoren beeinflusst.
1. Lithiumsalzauflösung
Der Elektrolyt besteht aus einem gelösten Stoff und einem Lösungsmittel. Der gelöste Stoff wird im Allgemeinen aus einer Flüssigkeit einer Kombination mehrerer organischer Lösungsmittel ausgewählt. Wenn LiPF6 in dem Lösungsmittel gelöst wird, werden Lithiumionen und negative PF6-Ionen gebildet. Die Auflösung des Lithiumsalzes hängt eng mit der Dielektrizitätskonstante des Lösungsmittels zusammen. Je größer die Dielektrizitätskonstante ist, desto stärker ist die Löslichkeit des Lithiumsalzes. Wenn Lithiumionen vollständig von Lösungsmittelmolekülen umgeben sind, wird die Wirkung negativer Ionen auf Lithiumionen abgeschwächt, was zu einer sogenannten Auflösung führt. Bei Lithiumsalzen ist die Ionenleitfähigkeit des Elektrolyten und seine eigene Auflösung umso besser, je größer das Anion ist. Je größer das Anion ist, desto leichter ist es, seine negative Ladung zu dispergieren und die Paarung von Kationen zu verhindern.
2. Elektrolytviskosität
Die Viskosität des Elektrolyten hat einen wichtigen Einfluss auf die Bewegung der Ionen. Je niedriger die Viskosität, desto günstiger ist die Bewegung der Ionen.
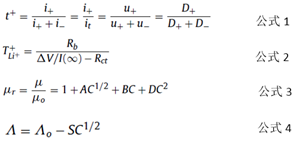
Lithiumionen werden unter dem Einfluss der Auflösung und Viskosität der Elektrodenflüssigkeit transportiert und übertragen. In Formel 1 ist t + die Anzahl der Transporte, i + und i- repräsentieren den durch das Kation bzw. das Anion gebildeten Strom, es repräsentiert den Gesamtstrom, u ± repräsentiert die Mobilität des Anions und des Kations und D ± repräsentiert die Diffusionskoeffizient des Anions und des Kations.
Tatsächlich hängt der Ionenwiderstand nicht nur mit Anion und Kation zusammen, sondern auch mit dem Lösungsmittel. Die Anzahl der Ionenwanderungen kann durch Gleichung 2 ausgedrückt werden:
Unter ihnen TLi ++ die Anzahl der Lithium - Ionen - Migration darstellt, Δ V ist die Polarisationsspannung, I (∞) ist der stationäre Strom nach der Polarisation und Rb und Rct ist der Volumenwiderstand und den Ladungsübertragungswiderstand.
Es ist schwierig, dass der Elektrolyt des einphasigen Lösungsmittelsystems sowohl eine hohe Leitfähigkeit als auch eine niedrige Viskosität aufweist. Daher wird das üblicherweise verwendete Elektrolytlösungsmittel durch eine Vielzahl von Lösungsmitteln formuliert, wie beispielsweise einen binären Elektrolyten. (Lithiumsalz) + (1-w) (Lösungsmittel A) + w (Lösungsmittel B), die Lithiumsalz-m-Einheit ist im Allgemeinen eine molare Konzentration, mol / kg, und w ist der Massenanteil des Lösungsmittels. Für Einheitselektrolyte gibt es keine zuverlässige Theorie zur Vorhersage der Viskosität und Ionenleitfähigkeit des Elektrolyten. Jones-Dole (JD) und Debye-Hückel-Onsager (DHO) haben zwei empirische Formeln vorgeschlagen, Gleichung 3 und Gleichung 4:
Wobei μr die relative Viskosität ist, μ die Lösungsviskosität ist, μ0 die reine Lösungsmittelviskosität ist, C die Lithiumsalzkonzentration ist, A, B und D Koeffizienten sind, Λ die molare Leitfähigkeit ist und Λ0 die molare Leitfähigkeit in der unendlicher Verdünnungszustand. S ist ein Parameter, der von den physikalischen Eigenschaften des Lösungsmittels und den Eigenschaften des Elektrolyten beeinflusst wird, und C ist die Konzentration des gelösten Stoffes. Die empirische Formel muss auch geändert werden, wenn sich die Arten von Lithiumsalzen und Lösungsmitteln ändern. Für gemischte Elektrolyte ist die Formel komplexer.
Wenn ein neuer Mehrkomponenten-Elektrolyt konfiguriert wird, muss daher die Leistung des Elektrolyten getestet werden, um bestimmt zu werden, und die Vorschätzung kann nicht durchgeführt werden. Obwohl die Ionenleitfähigkeit einen großen Einfluss auf die Batterieleistung hat, sind auch andere Faktoren wie die Bildung und Leistung von SEI sehr kritische Faktoren, und Stabilität, Toxizität und dergleichen des Elektrolyten bei hoher Vergrößerung sollten ebenfalls berücksichtigt werden. Kurz gesagt, alle Faktoren, die mit der tatsächlichen Produktionsanwendung zusammenhängen, sollten berücksichtigt werden, bevor die Ionenleitfähigkeitsparameter berücksichtigt werden.
Zweitens Festelektrolyt
Im Vergleich zu flüssigen organischen Elektrolyten haben Festelektrolyte größere Vorteile für Lithiumbatterien, wie einfaches Design, bequeme Verpackung, gute Stoß- und Vibrationsbeständigkeit, gute Temperatur- und Druckbeständigkeit, elektrochemische Stabilität und große Reichweite sowie Sicherheit. Guter Sex und so weiter. Die Ionenleitfähigkeit von Festelektrolyten ist jedoch relativ begrenzt. Im Allgemeinen können Festelektrolyte in Gelpolymere, lösungsmittelfreie Polymere, anorganische Kristallverbindungen, anorganische Glasmaterialien und dergleichen eingeteilt werden. Innerhalb der anorganischen kristallinen Verbindung beruht die Leitung von Lithiumionen auf der Migration mobiler Ionen zwischen den günstigen Energiestellen des umgebenden Potentials, und die Bewegung der umgebenden Ionen liefert Aktivierungsenergie für die sich bewegenden Ionen, um sie durchzulassen die Kanäle in der Kristallstruktur.
Der Ionentransportmechanismus des Polymerelektrolyten unterscheidet sich von dem der anorganischen Kristallverbindung und des flüssigen Elektrolyten. In lösungsmittelfreien Polymerelektrolyten wird die Ionenmobilität durch die Bewegung des Polymerwirtsmaterials beeinflusst. Die Ionen bewegen sich nur, wenn das Polymersegment eine beträchtliche Amplitudenbewegung erfährt, die mit der Glasübergangstemperatur (Tg) verbunden ist. Der Polymerelektrolyt zeigt eine schnelle Ionenleitfähigkeit bei einer Temperatur, die höher als die Glasübergangstemperatur Tg ist. In diesem Fall besteht der Polymerelektrolyt hauptsächlich aus einer amorphen Phase. Daher ist ein Polymer mit einer niedrigen Glasübergangstemperatur Tg wie PEO (Tg-50 bis -57 ° C) ein wichtiger Polymerwirt eines lösungsmittelfreien Elektrolyten geworden, und die Amorphisierung des Polymers wird untersucht, um seine Ionen zu erhöhen Leitfähigkeit. . Polymerelektrolyte vom Gel-Typ zeigen aufgrund der Diffusion von Lösungsmitteln mit niedrigem Molekulargewicht im Polymer und der Bewegung der Polymersegmente eine schnellere Ionenleitung als lösungsmittelfreie Elektrolyte.
Am Beispiel von PEO ist der Elektrolyttransportmechanismus dieses Polymertyps wie in der obigen Abbildung gezeigt. Nach der Elektrifizierung führt die Segmentbewegung des amorphen Teils des Polymers zum sich wiederholenden Prozess des "Dekomplexierungs-Rekombinations" -Prozesses von Li +. Schnelle Migration erreichen.
Festelektrolyte auf Basis der Dünnschichttechnologie, die in der Halbleiterindustrie entwickelt wurden, wurden intensiv als Schlüsselkomponenten von Festkörper-Mikrobatterien untersucht. Die Kosten für die meisten kristallinen und glasartigen Elektrolyte, die für Mikrobatterien entwickelt wurden, sind aufgrund langer Synthesezeiten und Hochtemperaturbedingungen im Herstellungsprozess zu hoch. Zusätzlich zu diesen Nachteilen enthalten anorganische Materialien für Festelektrolyte üblicherweise teure Metalle wie Ge, Ti, Sc, In, Lu, La und Y. Polymerelektrolyte vom Gel-Typ waren aufgrund der Schwierigkeiten beim Amplifizieren und Aufbringen kommerziell erfolgreich die meisten Festelektrolyte.
Drittens ionischer flüssiger Elektrolyt
Eine andere Klasse von Materialien, die als Elektrolyte betrachtet werden, ist die ionische Flüssigkeit. Die Definition der ionischen Flüssigkeit ist derzeit unklar und wird allgemein als eine Flüssigkeit angesehen, die vollständig aus Kationen und Anionen besteht und bei Raumtemperatur oder nahe Raumtemperatur ein flüssiges organisches Salz ist. Ionische Flüssigkeiten haben einzigartige Eigenschaften, einschließlich Nichtentflammbarkeit, niedrigem Dampfdruck, hoher thermischer Stabilität, guter elektrochemischer Stabilität, geringer Toxizität und hohem Ionengehalt.
Im Allgemeinen werden ionische Flüssigkeiten in drei Typen eingeteilt: eine ionische Flüssigkeit vom AlCl 3 -Typ, eine ionische Flüssigkeit vom Nicht-AlCl 3 -Typ und eine spezielle ionische Flüssigkeit. Die physikochemischen Eigenschaften verschiedener ionischer Flüssigkeiten sind in der einschlägigen Literatur zu finden. Im Allgemeinen ist die Viskosität der ionischen Flüssigkeit ein bis zwei Größenordnungen höher als die des flüssigen Elektrolyten, so dass die Ionenleitfähigkeit drei bis vier Größenordnungen niedriger ist als die Ionenleitfähigkeit des flüssigen Elektrolyten. Das Waldensche Gesetz wird üblicherweise für die Beziehung zwischen Leitfähigkeit und Viskosität ionischer Flüssigkeiten verwendet, ausgedrückt wie folgt:
λi ist die Ionenleitfähigkeit der Ionenspezies i und μ ist die Viskosität.
Da die Viskosität weitgehend durch die Wechselwirkung von Einflüssen wie Van-der-Waals-Wechselwirkungen, Konformationsfreiheitsgraden, Coulomb-Kräften und Ionenformen bestimmt wird, haben die Forscher erhebliche Anstrengungen unternommen, um die Wechselwirkung ionischer Substanzen in ionischen Flüssigkeiten zu untersuchen. Zusätzlich zu der geringen Ionenleitfähigkeit ist es unwahrscheinlich, dass ionische flüssige Elektrolyte SEI-Schichten auf Kohlenstoffanodenmaterialien bilden, was zu einer Erschöpfung der zirkulierenden Li-Ionen führt. Daher erfordern ionische Flüssigkeiten in vielen Fällen die Verwendung von Additiven als Elektrolyte.
Die Seite enthält den Inhalt der maschinellen Übersetzung.
 Hinterlass eine Nachricht
Hinterlass eine Nachricht



Wir melden uns bald bei Ihnen